
光声成像
光声成像(Photoacoustic Imaging, PAI)是近年来发展起来的一种非入侵式和非电离式的新型生物医学成像方法。当脉冲雷射照射到(热声成像则特指用无线电频率的脉冲雷射进行照射)生物组织中时,组织的光吸收域将产生超声信号,我们称这种由光激发产生的超声信号为光声信号。生物组织产生的光声信号携带了组织的光吸收特徵信息,通过探测光声信号能重建出组织中的光吸收分布图像。光声成像结合了纯光学组织成像中高选择特性和纯超声组织成像中深穿透特性的优点,可得到高解析度和高对比度的组织图像,从原理上避开了光散射的影响,突破了高解析度光学成像深度“软极限”(~1 mm),可实现50 mm的深层活体内组织成像。
基本介绍
- 中文名:光声成像
- 外文名:Photoacoustic Imaging, PAI
- 拼音:guang sheng cheng xiang
- 性质:无损医学成像方法
- 作用:提供高解析度高对比度的组织成像
- 相关领域:医学
1、研究套用历史
光声效应最早于1880年由贝尔发现。贝尔发现用周期性的光照射一个吸收体时, 该物质吸收光会产生声信号, 这种声信号的频率与入射光的调製频率相同, 而且声信号的强度随样品吸收光的增加而增加。由于当时没有强的光源和灵敏的探测器, 贝尔的发现没有得到套用。在此之后的近80年,关于光声效应的研究与套用几乎没有进展。20世纪60年代以后,由于微信号检测技术的发展,高灵敏微音器和压电陶瓷传声器的出现,以及强光源(雷射器、氙灯等)的问世,光声效应及其套用的研究又重新活跃起来。L B Kruezer将光声效套用于气体成分的检测,关于光声效应的研究才重新受到人们的重视。基于光声效应发展起来的光谱技术也随之发展起来并且套用于测定传统光谱法难以测定的光散射强或不透明的样品,如凝胶,溶胶,粉末,生物试样等,广泛套用于物理、化学、生物医学和环境保护等领域。在此之后,光声效应陆续被套用于各个领域中,但进展仍相当迟缓。直到90年代后期,基于光声效应的光声成像技术才迅速发展起来并被广泛套用于生物医学领域。
2、光声成像原理与系统
光声信号产生的基本原理是:当用短脉冲雷射照射吸收体时,吸收体中的分子吸收光子后,当满足一定的条件时,吸收体分子的电子从低能级跃迁到高能级而处于激发态,而处于激发态的电子极不稳定,当电子从高能级向低能级跃迁时,会以光或热量的形式释放能量。在光声成像套用中通常会选择合适波长的雷射作为激发源,使吸收的光子的能量转化为热能的效率最大,通常从光能转化为热能的效率可达到90%以上。释放的热量导致吸收体局部温度升高,温度升高后导致热膨胀而产生压力波,这就是光声信号。因此,光声信号的产生过程就是“光能”-“热能”-“机械能”的转化过程。
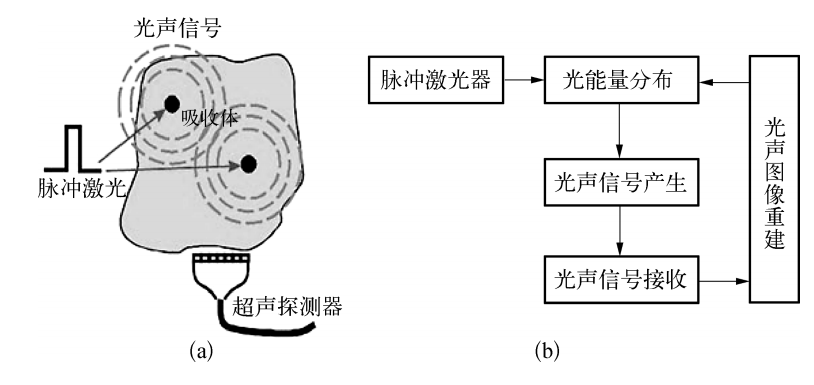
图1 光声成像工程 (a)光声信号激发与探测;(b)光声成像实现过程示意图
光声成像过程可以分为三个部分:信号的产生、信号的接收和信号处理及图像重建(见图1)。由于脉冲雷射器具有光声转换效率高的优点,因此通常被作为光声成像研究中产生信号的激励源。脉冲雷射器发出的雷射束照射在待研究组织样品上,由于组织样品的吸收效应,在样品内部形成了与组织光学参数相关的能量沉积分布。由于雷射脉宽很窄(ns)吸收的能量不能在短时间内释放,导致瞬间温度变化,从而通过热弹机制转化为热膨胀。周期性热流使周围的介质热胀冷缩而激发超音波,由于这种超音波信号的特殊产生机理,为了区别于其它的超声信号,通常称为光声信号。利用超声探测器接收光声信号并对採集到的信号进行适当地处理和採用相应的图像重建算法,就能够得到样品内部光能量沉积的分布。当保证入射光的均匀性的前提下,光声重建图像与吸收分布具有一一对应的关係。
3、技术特点
光声成像将光学成像和超声成像的优点结合起来,一方面,在光声成像中用来重建图像的信号是超声信号,生理组织对超声信号的散射要比光信号低2到3个数量级,因此它可以提供较深的成像深度和较高的空间解析度;另一方面,光声成像根据不同组织对可见光、近红外光或无线电频率(Radio frequency)电磁波的选择性吸收,利用特定波长的雷射脉冲对组织进行照射,并间接地对脉冲能量在生理组织中的吸收分布进行成像,成像的是被“吸收”的光能,这在纯光学成像中是无法做到的,因此相比纯超声成像,光声图像中不同组织间的光学对比度较高。光声成像与传统医学影像技术相比具有如下特点:
第一,由于雷射的窄线宽,利用生物组织的高光谱选择性吸收差异,光声成像能够实现高特异性光谱组织的选择激发, 不仅可以反映组织结构特徵,更能够实现功能成像,开创了一种有别于传统医学影像技术的新成像方法与技术手段。
第二,光声成像结合了光学成像和声学成像的优点。一方面,比纯光学成像穿透更深(可突破雷射共聚焦显微成像(LCSM)、双光子激发显微成像(TPEF)、光学弱相干层析成像(OCT)等高解析度光学成像深度“软”极限(~1mm);另一方面,比传统的MRI以及PET成像拥有更高的解析度;其图像解析度可达到亚微米、微米量级,可实现高解析度的分子成像。
第三,光声成像是一种非侵入式成像技术,这对于在体成像非常重要。由于使用的雷射功率密度低于生物组织损伤阈值,组织中产生的超声场强度远远低于组织的损伤阈值,所以光声成像是一种非入侵、非电离的无损伤的成像技术。
第四,随着光声成像系统的一体化、小型化,该成像系统比传统的MRI以及PET脑功能成像系统价格更便宜,使用更便捷,利于普及和推广。
因此,无损光声成像作为一种新兴的医学影像技术,能够在一定的深度下获得足够高的解析度和图像对比度,图像传递的信息量大,可以提供形态及功能信息,在生物医学套用领域具有广阔的套用前景。
4、研究分支
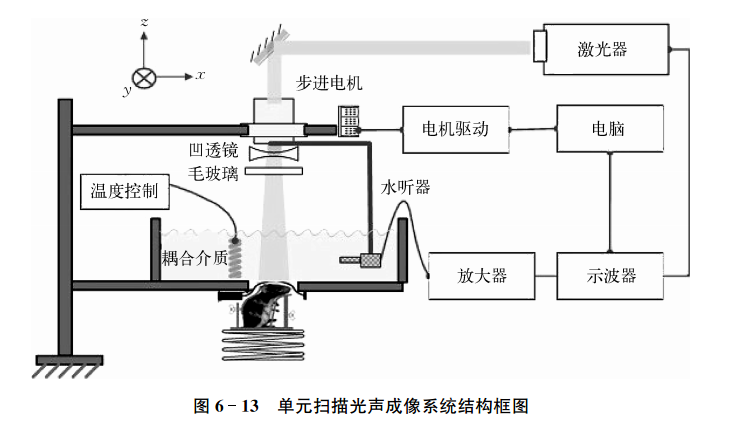 图2 光声断层成像系统构架图
图2 光声断层成像系统构架图图2 光声断层成像系统构架图

图3 光声显微镜系统 (a)多轴光纤;(b)聚焦透镜;(c)锥型透镜;(d)光学聚焦镜和超声探测器;(e)水箱;(f)动物固定支架;(g)採样器和参考光纤;(h)温度控制器;(i)电机电源;(j)计算机;(k)数字示波器;(l)控制电机的计算机
目前光声成像的主要研究分支有光声断层成像(Photoacoustic tomography, PAT,见图2)、光声显微成像(Photoacoustic microscopy, PAM,见图3)、光声内窥成像(Intravascular photoacoustic imaging, IVPAI)。光声断层成像清晰地探测到活体小鼠脑血管分布(见图4),根据血容量、血流、血氧等参数反映了脑功能信息。光声成像技术将为脑功能研究提供新的技术手段。基于光声成像反映光吸收的特性,研究者发展了多波长光声成像技术并且套用于肿瘤成像,获得高解析度的肿瘤新生血管的形态学信息、由血氧饱和度反映的肿瘤代谢信息。光声成像技术为肿瘤的早期诊断与治疗监控提供了强大的技术支持。多波长光声成像在检测活体深层萤光蛋白表达以及基因活性方面取得令人振奋的效果。多波长内窥光声成像针对动脉粥样硬化斑块进行检测,通过光谱解析获得了动脉粥样硬化斑块组份信息(见图5),为光声内窥成像套用于心脑血管疾病检测奠定了实验基础。随着光声显微镜的出现,光声成像发展到了一个新的阶段。光声显微镜将横向解析度提高了一个数量级达到了45µm。利用光声显微成像技术不仅可以获得高解析度黑色素瘤的实体和周围的微血管的形态结构图像(见图6),还可以得到活体动物的血氧饱和度信息(见图7)。亚波长光学解析度光声显微镜的出现将光声成像技术的解析度提高到前所未有的高度,达到了221 nm。光学解析度的光声显微镜(OR-PAM)可以轻而易举地对黑色素瘤细胞和血红细胞进行单细胞成像。光声纳米探针的发展为光声成像增添了活力。基于外源光声纳米探针,研究者们发展了光声分子成像和光声治疗。光声分子成像实现了在磁环境中对在血液中循环的肿瘤细胞进行探测以确定肿瘤细胞是否转移,最后发展成了光声流式细胞仪。
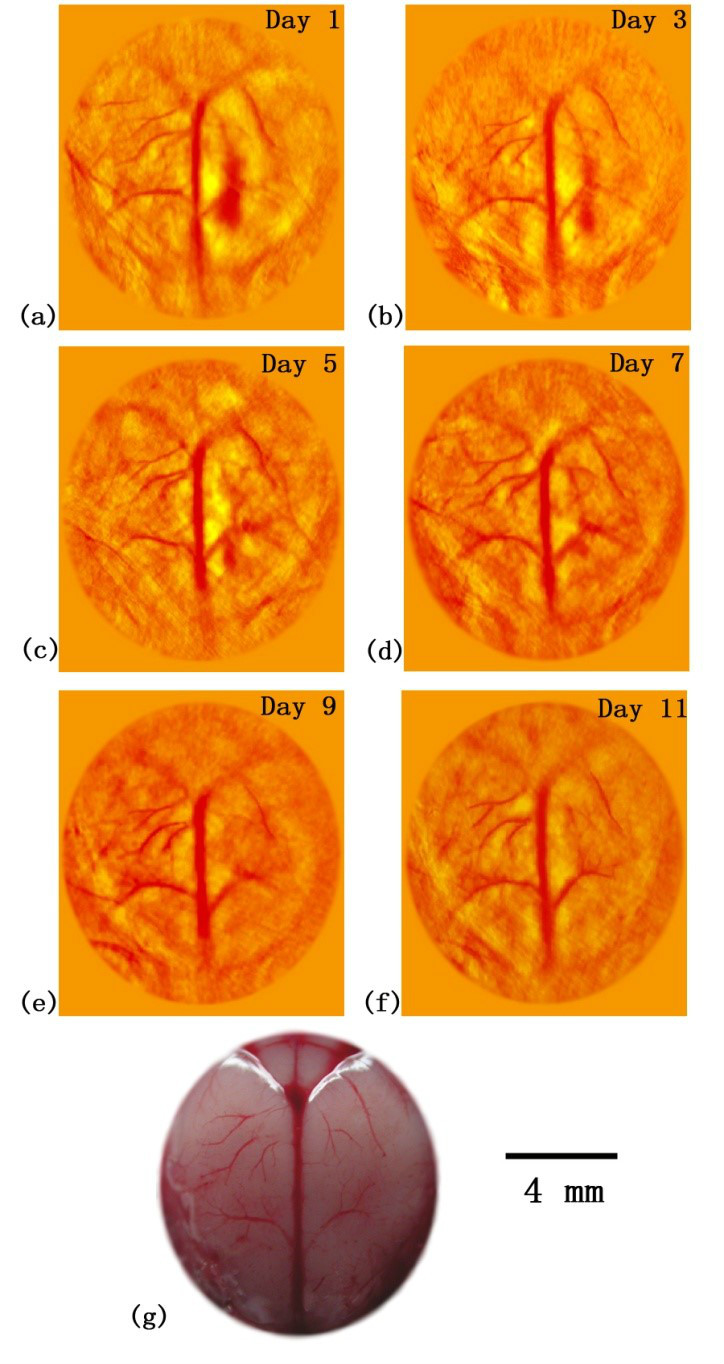
图4 光声脑部损伤恢复过程的连续监控成像,(a)~(f)分别为小鼠损伤后第1天、3天、5天、7天、9天和11天的脑部皮层血管光声重建图像;(g)为损伤恢复后小鼠脑部解剖照片
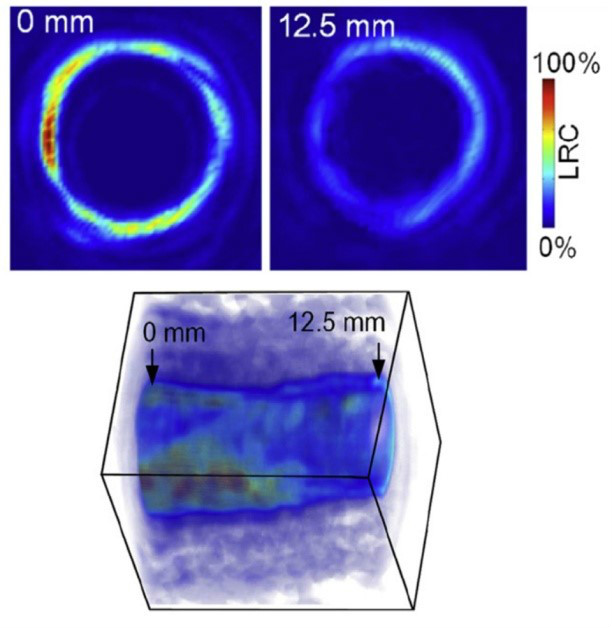
图5 通过光谱解析方法获得的动脉粥样硬化血管内窥光声图像
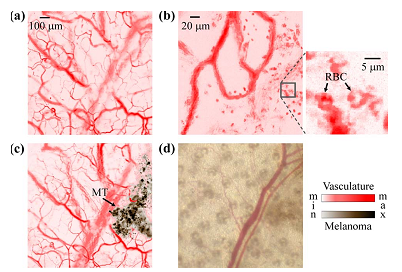
图6 光声显微镜监测小鼠耳部黑色素瘤生长过程 (a)注射黑色素瘤前小鼠耳部血管的光声显微成像结果;(b)注射部位的在体光声成像,RBC表示红细胞;(c)注射黑色素瘤细胞4天后血管网路光声图像,MT表示黑色素瘤;(d)光学显微成像结果。

图7 使用第二代光学解析度的显微镜检测老鼠耳朵中血氧含量
作为新一代的无损医学成像技术,光声成像可以无标记地对单个细胞成像、可以对血管形态的高分辨成像、对不同组织的成份进行解析和对血液参数高特异性的功能检测。光声成像实现了从细胞到组织结构的多尺度示蹤及功能成像。光声成像可以用于研究动物体脑功能、肿瘤细胞转移和肿瘤形态结构,生理、病理特徵,血流异常、药物代谢功能、深层萤光蛋白表达、基因活性等方面的内容,为生物医学套用领域提供了重要研究及监测手段,具有良好的发展前景和广泛的生物医学套用潜力。预期光声成像技术将会引起基础生命科学以及临床医学影像领域的变革。
5、光声成像套用
光声成像能够有效的进行生物组织结构和功能成像,为研究生物组织的形态结构,生理特徵,病理特徵,代谢功能等提供了重要的手段,特别适合于癌症的早期检测和治疗监控。目前的光声成像技术多用于科研,光声成像已经成为一个快速发展的研究领域,现今光声技术正由微观实验室阶段逐步走向巨观临床实践阶段。
光声成像目前可用于:
1. 心血管研究:对小动物活体进行心血管疾病(血管生成/生长、心肌炎、血栓、心梗等)的深入研究,系统可输出血红蛋白浓度和血氧饱和度的定量数据。
2. 药物代谢研究:利用分子影像学技术,实时监测标记药物在动物体内的运动情况,从而判断该药物是否能够準确到达靶区和代谢途径,以及治疗效果评测。
3.肿瘤研究:直接快速地测量和跟蹤各种癌症模型中肿瘤的生长和转移,及伴随的血管生成过程,如肝癌模型、骨转移模型等;并可对肿瘤的生长和转移(或癌症治疗)中血红蛋白浓度和血氧饱和度的变化、血管生成抑制效果等信息进行实时成像与分析。
4. 基因表达:在活体动物体内观察和研究基因的表达, 细胞或组织特异性, 及其治疗反应。
5.干细胞及免疫研究:标记细胞,实时观测动物体内干细胞治疗效果,并用于抗肿瘤免疫治疗。
6.细菌与病毒研究:通过对细菌与病毒进行特异性萤光探针标记,研究侵染过程等。转基因动物模型:如大小鼠的疾病模型。
7.疾病早期诊断:用分子影像学可对分子水平的病变进行检测,遭遇以病理改变为评判基础疾病诊断,实现疾病早期诊断。
及其它套用领域:如分子光学、脑科学研究等。
扩展阅读
- 1. S. H. Yang, D. Xing, Y. Q. Lao, D. W. Yang, L. M. Zeng, L. Z. Xiang and W. R. Chen, Noninvasive monitoring of traumatic brain injury and post-traumatic rehabilitation with laser-induced photoacoustic imaging, Appl. Phys. Lett. 90, 243902 (2007).
- J. Zhang,S. H. Yang, X. R. Ji, Q. Zhou and D. Xing, Characterization of Lipid-Rich Aortic Plaques by Intravascular Photoacoustic Tomography: Ex Vivo and In Vivo Validation in a Rabbit Atherosclerosis Model with Histologic Correlation, J Am Col Cardiol, 64(4), 385-390, (2014).
- Y. Zhao, S. H. Yang, C. G. Chen, and D. Xing, Simultaneous optical absorption and viscoelasticity imaging based on photoacoustic lock-in measurement, Opt. Lett.,39(9), 2565, (2014).
- H. Qin, T. Zhou, S. H. Yang, Q. Chen and D. Xing, GdIII-gold nanorods for MRI and PAI dual-modality detection of macrophages in atherosclerotic inflammation, Nanomedicine,8(10), 1611-1624, (2013).
- J. P. Zhong, S. H. Yang, X. H. Zheng, T. Zhou and D. Xing, In vivo photoacoustic therapy with cancer-targeted indocyanine green-containing nanoparticles, Nanomedicine, 8(6), 903-919, (2013).
- Z. J. Chen, S. H. Yang and D. Xing, In vivo detection of hemoglobin oxygen saturation andcarboxyhemoglobin saturationwith multiwavelength photoacoustic microscopy, Opt. Lett., 37(16), 3414-3416, (2012).
- 7. S. H. Yang, F. Ye and D. Xing, Intracellular label-free gold nanorods imaging with photoacoustic microscopy, Opt. Express., 20(9), 10370, (2012).
- G. D. Gao, S. H. Yang, D. Xing, Viscoelasticity imaging of biological tissues withphase-resolved photoacoustic measurement,Opt. Lett.,36, 3341-3343, (2011).
- F. Ye, S. H. Yang and D. Xing, Three-dimensional photoacoustic imaging system in line confocal modefor breast cancer detection, Appl. Phys. Lett., 97(21), 213702, (2010).
- S. H. Yang, D. Xing, Q. Zhou, L. Z. Xiang and Y. Q. Lao, Functional imaging of cerebrovascular activities in small animalsusing high-resolution photoacoustic tomography, Med. Phys., 34(8), 3294-3301, (2007).
- H. Wang, D. Xing and L. Xiang, Photoacoustic imaging using an ultrasonic Fresnel zone plate transducer, Appl. Phys. 41 (2008).
- Y. Yuan, S. H. Yang and D. Xing, Optical-resolution photoacoustic microscopy based on two dimensional scanning galvanometer, Appl. Phys. Lett. 100, 0237021-3 (2012).
- B. B. Li, H. Qin, S. H. Yang and D. Xing, In vivo fast variable focus photoacoustic microscopy using an electrically tunable lens, Opt. Express., 22(17), 20130, (2014).
- X. D. Wang, Y. J. Pang, G. Ku et al. Noninvasive laser-induced photoacoustic tomography for structural and functional in vivo imaging of the brain, Nature Biotechnology, 21,803-806, (2003).
- H. F. Zhang, K. Maslov, G. Stoica et al, Functional photoacoustic microscopy for high-resolution and noninvasive in vivo imaging, Nature Biotechnol., 24, 848-851, (2006).
- Y. G. Zeng, D. Xing, Y. Wang et al, Photoacoustic and ultrasonic co-image with a linear transducer array, Opt. Lett., 29, 1760-1762, (2004).
- H. F. Zhang, K. Maslov, L. H. Wang, In vivo imaging of subcutaneous structures using functional photoacoustic microscopy, Nat. Protoc., 2, 797-804, (2007).
- G. Ku, L. V. Wang, Deeply penetrating photoacoustic tomography in biological tissues enhanced with an optical contrast agent, Opt. Lett., 30, 507-509, (2005).
 海之美文新闻资讯
海之美文新闻资讯