
二氧化碳
二氧化碳(carbon dioxide),一种碳氧化合物,化学式为CO2,化学式量为44.0095,常温常压下是一种无色无味或无色无嗅(嗅不出味道)而略有酸味的气体,也是一种常见的温室气体,还是空气的组分之一(占大气总体积的0.03%-0.04%)。在物理性质方面,二氧化碳的熔点为-78.5℃,沸点为-56.6℃,密度比空气密度大(标準条件下),微溶于水。在化学性质方面,二氧化碳的化学性质不活泼,热稳定性很高(2000℃时仅有1.8%分解),不能燃烧,通常也不支持燃烧,属于酸性氧化物,具有酸性氧化物的通性,因与水反应生成的是碳酸,所以是碳酸的酸酐。
二氧化碳一般可由高温煅烧石灰石或由石灰石和稀盐酸反应製得,主要套用于冷藏易腐败的食品(固态)、作致冷剂(液态)、製造碳化软饮料(气态)和作均相反应的溶剂(超临界状态)等。关于其毒性,研究表明:低浓度的二氧化碳没有毒性,高浓度的二氧化碳则会使动物中毒。
基本介绍
- 中文名:二氧化碳
- 英文名:carbon dioxide
- 别称:碳酸气、碳酸酐、乾冰(固态)等
- 化学式:CO2
- 分子量:44.0095
- CAS登录号:124-38-9
- EINECS登录号:204-696-9
- 熔点:-78.5℃(升华点)
- 沸点:-56.6℃(527kPa)
- 水溶性:小于0.05%(22.9℃)
- 外观:常温常压下是一种无色无味或无色无嗅而略有酸味的气体
- 闪点:无
- 套用:冷藏易腐败的食品、作致冷剂、製造碳化软饮料等
- 气态密度:1.997g/L(0℃,101.325kPa)
- 液态密度:0.9295kg/L(0℃,101.3485kPa)
- 固态密度:1.56kg/L(-79℃)
- 三相点:-56.6℃(517.97kPa)
- 製备方法:石灰石和稀盐酸反应製取等
- 分子直径:0.35~0.51nm
研究简史
原始社会时期,原始人在生活实践中就感知到了二氧化碳的存在,但由于历史条件的限制,他们把看不见、摸不着的二氧化碳看成是一种杀生而不留痕迹的凶神妖怪而非一种物质。
公元三世纪,中国西晋时期的张华(232年—300年)在所着的《博物志》一书记载了一种在烧白石(CaCO3)作白灰(CaO)过程中产生的气体,这种气体便是如今工业上用作生产二氧化碳的石灰窑气。
十七世纪初,比利时医生海尔蒙特(即扬·巴普蒂斯塔·范·海尔蒙特,Jan Baptista van Helmont,1580年—1644年)发现木炭燃烧之后除了产生灰烬外还产生一些看不见、摸不着的物质,并通过实验证实了这种被他称为“森林之精”的二氧化碳是一种不助燃的气体,确认了二氧化碳是一种气体;还发现烛火在该气体中会自然熄灭,这是二氧化碳惰性性质的第一次发现。在海尔蒙特之后不久,德国化学家弗里德里希·霍夫曼(Friedrich Hoffmann,1660年—1742年)对被他称为“矿精(spiritus mineralis)”的二氧化碳气体进行研究,首次推断出二氧化碳水溶液具有弱酸性。
1756年,英国化学家约瑟夫·布莱克(Joseph Black,1728年—1799年)第一个用定量方法研究了被他称为“固定空气”的二氧化碳气体,二氧化碳在此后一段时间内都被称作“固定空气”。
1766年,英国科学家卡文迪许(即亨利·卡文迪许,Henry Cavendish,1731年—1810年)成功地用汞槽法收集到“固定空气”,并用物理方法测定了其比重及溶解度,还证明了它和动物呼出的和木炭燃烧后产生的气体相同。
1772年,法国科学家拉瓦锡(即安托万-洛朗·拉瓦锡,Antoine-Laurent de Lavoisier,1743年—1794年)等用大火镜聚光加热放在汞槽上玻罩中的钻石,发现它会燃烧,而其产物即“固定空气”。同年,科学家约瑟夫·普里斯特利(J.Joseph Priestley,1733年—1804年)研究发酵气体时发现:压力有利于被称为“固定空气”的二氧化碳在水中的溶解,温度增高则不利于其溶解。这一发现使得二氧化碳能被套用于人工製造碳酸水(汽水)。
1774年,瑞典化学家贝格曼(Torbern Olof Bergman,1735年—1784年)在其论文《研究固定空气》中叙述了他对“固定空气”的密度、在水中的溶解性、对石蕊的作用、被硷吸收的状况、在空气中的存在、水溶液对金属锌、铁的溶解作用等的研究成果。
1787年,拉瓦锡在发表的论述中讲述将木炭放进氧气中燃烧后产生的“固定空气”,肯定了“固定空气”是由碳和氧组成的,由于它是气体而改称为“碳酸气”。同时,拉瓦锡还测定了它含碳和氧的质量比,碳占23.4503%,氧占76.5497%,首次揭示了二氧化碳的组成。
1797年,英国化学家史密森·坦南特(Smitbson Tennant,1761年—1815年,又译“台耐特”等)用分析的方法测得被他称为“固定空气”的二氧化碳含碳27.65%、含氧72.35%。
1823年,英国科学家法拉第(即麦可·法拉第,Michael Faraday,1791年—1867年)发现加压可以使二氧化碳气体液化。同年,法拉第和汉弗莱·戴维(Humphry Davy,1778年—1829年,又译“笛彼”)首次液化了二氧化碳。
1834年或1835年,德国人蒂罗里尔(即阿德里安·让·皮埃尔·蒂罗里尔,Adrien-Jean-Pierre Thilorier,1790年—1844年,又译“蒂洛勒尔”、“狄劳里雅利”、“奇洛列”等)成功地製得固体二氧化碳(乾冰)。
1840年,法国化学家杜马(即让-巴蒂斯特·安德烈·杜马,Jean-Baptiste André Dumas,1800年—1884年)把经过精确称量的含纯粹碳的石墨放进充足的氧气中燃烧,并且用氢氧化钾溶液吸收生成的二氧化碳气体,计算出二氧化碳中氧和碳的质量分数比为72.734:27.266。化学家们结合氧和碳的原子量得出二氧化碳中氧和碳的原子个数简单的整数比是2:1,又通过实验(以阿伏伽德罗于1811年提出的假说“在同一温度和压强下,相同体积的任何气体都含有相同数目的分子”为依据)测出二氧化碳的分子量为44,从而得出二氧化碳的化学式为CO2,与此化学式相应的名称便是“二氧化碳”。
1850年,爱尔兰物理化学家安德鲁斯(即托马斯·安德鲁斯,Thomas Andrews,1813年—1885年)开始对二氧化碳的超临界现象进行研究,并于1869年测定了二氧化碳的两个临界参数:超临界压强为7.2MPa,超临界温度为304.065K(二者在2013年的公认值分别为7.375MPa和303.05K)。
1896年,瑞典化学家阿累尼乌斯(即斯万特·奥古斯特·阿累尼乌斯,Svante August Arrhenius,1859年—1927年)通过计算指出,大气中二氧化碳浓度增加一倍,可使地表温度上升5~6℃。
20世纪50年代初,苏联、日本等国学者通过研究成功地将二氧化碳气体套用于焊接,由此产生了二氧化碳气体保护焊。
分子结构
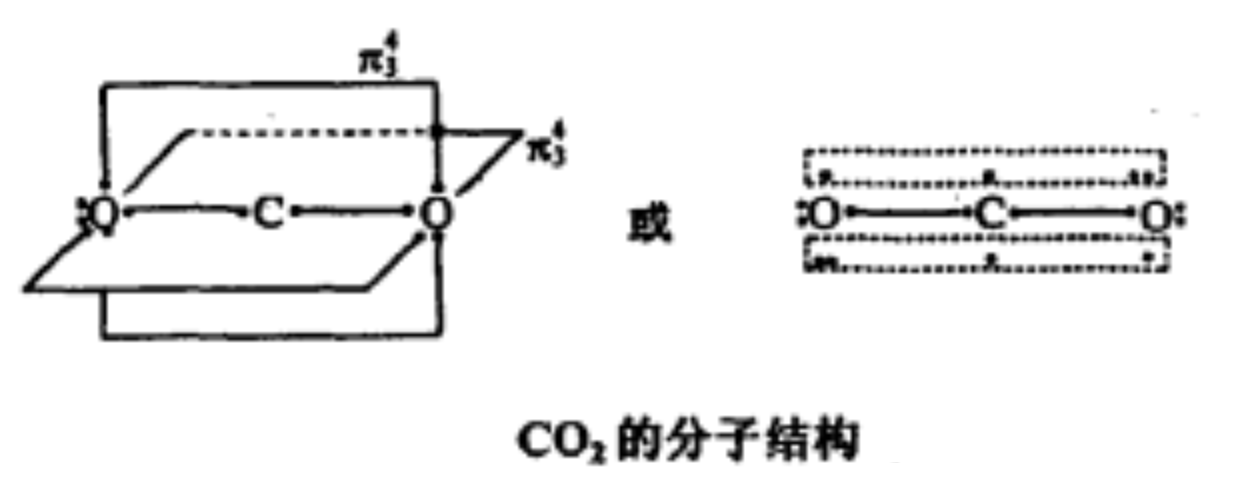 | 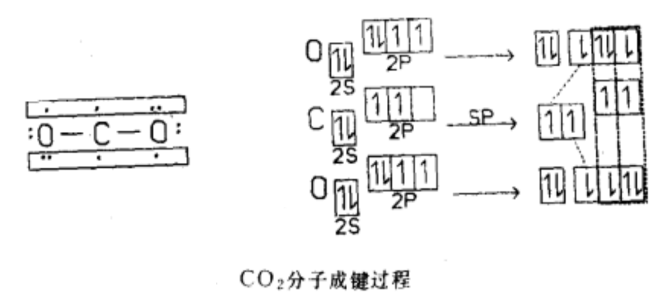 |
CO2分子结构 | CO2成键过程 |
CO2分子形状是直线形的,其结构曾被认为是:O=C=O。但CO2分子中碳氧键键长为116pm,介于碳氧双键(键长为124pm)和碳氧三键(键长为113pm)之间,故CO2中碳氧键具有一定程度的叄键特徵。
现代科学家一般认为CO2分子的中心原子C原子採取sp杂化,2条sp杂化轨道分别与2个O原子的2p轨道(含有一个电子)重叠形成2条σ键,C原子上互相垂直的p轨道再分别与2个O原子中平行的p轨道形成2条大π键。
理化性质
物理性质
二氧化碳在常温常压下为无色无味气体,溶于水和烃类等多数有机溶剂,其相关物理常数如下表:
| 性质 | 条件或符号 | 单位 | 数据 |
|---|---|---|---|
熔点 | 摄氏度(℃) | -78.5 | |
沸点 | 527kPa | 摄氏度(℃) | -56.6 |
相对密度 | -79℃,水=1 | 1.56 | |
相对蒸气密度 | 空气=1 | 1.53 | |
饱和蒸气压 | -39℃ | 千帕(kPa) | 1013.25 |
临界温度 | 摄氏度(℃) | 31.3 | |
临界压力 | 兆帕(MPa) | 7.39 | |
辛醇/水分配係数 | 0.83 | ||
折射率 | 12.5~24℃ | 1.173~1.999 | |
摩尔折射率 | 6.98 | ||
黏度 | 21℃,5.92MPa | 毫帕斯卡秒(mPa·s) | 0.0697 |
蒸发热 | 升华 | 千焦每摩尔(kJ/mol) | 25.25 |
熔化热 | 千焦每摩尔(kJ/mol) | 8.33 | |
生成热 | 千焦每摩尔(kJ/mol) | 394.40 | |
比热容 | 20℃,定压 | 千焦每千克开尔文[kJ/(kg·K)] | 2.8448 |
蒸气压 | 5.9~14.9℃ | 兆帕(MPa) | 4.05~5.07 |
热导率 | 12~30℃ | 瓦每米开尔文[W/(m·K)] | 0.10048~83.74×10-7 |
体膨胀係数 | -50~0℃ | 每开尔文(K-1) | 0.00495 |
0~20ºC | 每开尔文(K-1) | 0.00991 | |
摩尔体积 | 毫升每摩尔(mL/mol) | 44.7 | |
等张比容 | 90.2K | 60.9 | |
表面张力 | 达因每厘米(dyne/cm) | 3.4 | |
极化率 | 10-24cm3 | 2.76 |
(参考资料:)
化学性质
二氧化碳是碳氧化合物之一,是一种无机物,不可燃,通常也不支持燃烧,低浓度时无毒性。它也是碳酸的酸酐,属于酸性氧化物,具有酸性氧化物的通性,其中碳元素的化合价为+4价,处于碳元素的最高价态,故二氧化碳具有氧化性而无还原性,但氧化性不强。
1.酸性氧化物的通性
- 1-1.和水反应
二氧化碳可以溶于水并和水反应生成碳酸,而不稳定的碳酸容易分解成水和二氧化碳,相应的化学反应方程式为:
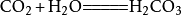

- 1-2.和硷性氧化物反应
一定条件下,二氧化碳能与硷性氧化物反应生成相应的盐,如:

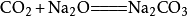
- 1-3.和硷反应
①与氢氧化钙反应
向澄清的石灰水中加入二氧化碳,会使澄清的石灰水变浑浊,生成碳酸钙沉澱(此反应常用于检验二氧化碳),相应的化学反应方程式为:
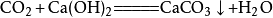
当二氧化碳过量时,生成碳酸氢钙:
第一步: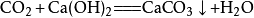 ;
;
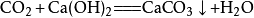
第二步: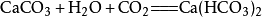 ;
;
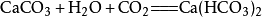
总方程式: 。
。

由于碳酸氢钙溶解性大,长时间往已浑浊的石灰水中通入二氧化碳,可发现沉澱渐渐消失。
②与氢氧化钠反应
二氧化碳会使烧硷变质,相应的化学反应方程式为:
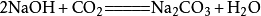
当二氧化碳过量时,生成碳酸氢钠:
第一步: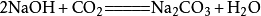 ;
;
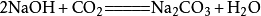
第二步: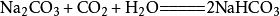 ;
;
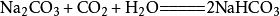
总方程式: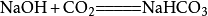 。
。
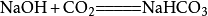
2.弱氧化性
- 2-1.碳单质还原
高温条件下,二氧化碳能与碳单质反应生成一氧化碳,相应的化学反应方程式为:
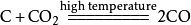
- 2-2.镁单质还原
在点燃的条件下,镁条能在二氧化碳中燃烧,相应的化学反应方程式为: 镁在二氧化碳中燃烧
镁在二氧化碳中燃烧
 镁在二氧化碳中燃烧
镁在二氧化碳中燃烧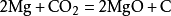
- 2-3.氢化还原
二氧化碳和氢气在催化剂的作用下会发生生成甲醇、一氧化碳和甲烷等的一系列反应,其中几种反应的化学反应方程式为:
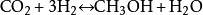
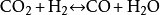
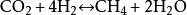
- 2-4.电化学还原
二氧化碳的电化学还原是一个利用电能将二氧化碳在电解池阴极还原而将氢氧根离子在电解池阳极氧化为氧气的过程,由于还原二氧化碳需要的活化能较高,这个过程需要加一定高电压后才能实现,而在阴极发生的氢析出反应的程度随电压的增加而加大,会抑制了二氧化碳的还原,故二氧化碳的高效还原需要有合适的催化剂,以致二氧化碳的电化学还原往往是个电催化还原过程。这个过程的简单机理为:⑴电解池阴极:在初始阶段,二氧化碳被吸附在阴极催化剂表面,形成中间产物(反应式①);然后电子在两个电极间电势差的作用下发生转移,转移数可能是2、4、6、8、12,还原产物随电子转移数的不同而可能是一氧化碳、甲酸根、甲酸等(反应式②-④)。⑵电解池阳极:水溶液中发生析氢反应,产生氢气(反应式⑤、⑥)。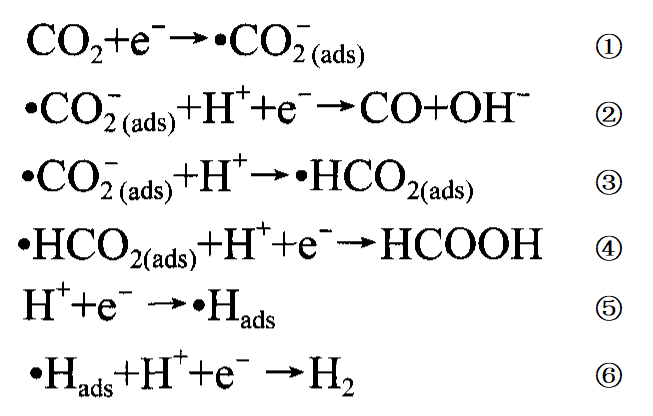 二氧化碳电化学还原反应
二氧化碳电化学还原反应
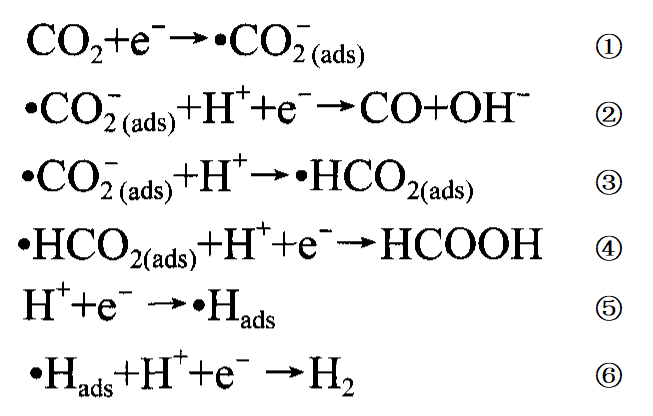 二氧化碳电化学还原反应
二氧化碳电化学还原反应3.与过氧化物反应
二氧化碳能与过氧化钠(Na2O2)反应生成碳酸钠(Na2CO3)和氧气(O2),相应的化学反应方程式为: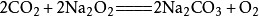 。
。
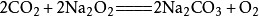
4.与格式试剂反应
在酸性条件下,二氧化碳能和格式试剂在无水乙醚中反应生成羧酸,相应的化学反应方程式为:

说明:式子中R为脂肪烃基或芳香烃基,X为卤素,Etheranhydrous表示无水乙醚。
5.与环氧化合物的插入反应
二氧化碳可以和环氧化合物在电催化作用下可反应生成环状碳酸酯,相应的化学反应方程式为:
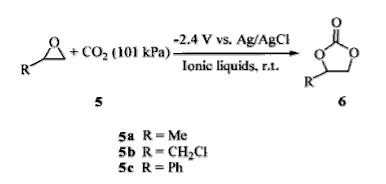 二氧化碳的插入反应
二氧化碳的插入反应6.製取金刚石(置换反应)
在440℃(713.15K)和800个大气压(约808MPa)的条件下,二氧化碳可与金属钠反应生成金刚石,相应的化学反应方程式为: 。
。

7.光合作用暗反应
二氧化碳参与了光合作用的暗反应,是绿色植物光合作用不可缺少的原料,其参与的反应过程被称为“二氧化碳的固定”,相应的化学反应方程式为: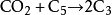
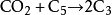
说明:式子中C5为1,5-二磷酸核酮糖,2C3为2分子3-磷酸甘油酸。
产生途径
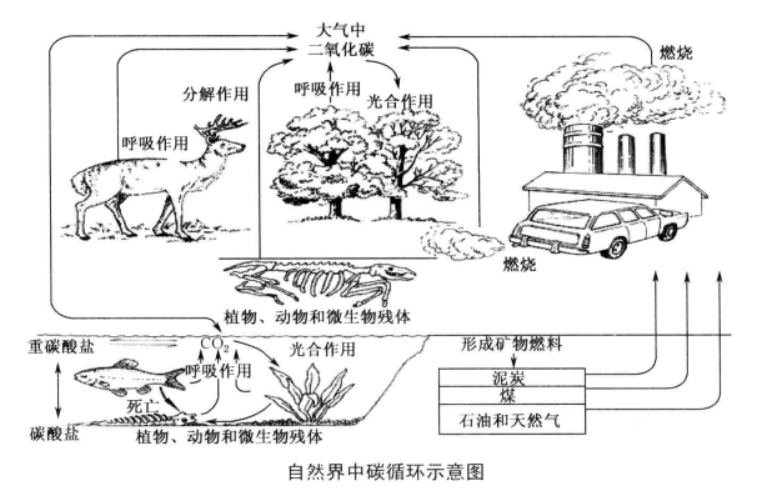 自然界中碳循环示意图
自然界中碳循环示意图二氧化碳气体是大气组成的一部分(占大气总体积的0.03%-0.04%),在自然界中含量丰富,其产生途径主要有以下几种:①有机物(包括动植物)在分解、发酵、腐烂、变质的过程中都可释放出二氧化碳。②石油、石腊、煤炭、天然气燃烧过程中,也要释放出二氧化碳。③石油、煤炭在生产化工产品过程中,也会释放出二氧化碳。④所有粪便、腐植酸在发酵,熟化的过程中也能释放出二氧化碳。④所有动物在呼吸过程中,都要吸氧气吐出二氧化碳。
製备方法
工业製备
- 煅烧法
高温煅烧石灰石(或白云石)过程中产生的二氧化碳气,经水洗、除杂、压缩,製得气体二氧化碳:

- 发酵气回收法
生产乙醇发酵过程中产生的二氧化碳气体,经水洗、除杂、压缩,製得二氧化碳气。
- 副产气体回收法
氨、氢气、合成氨生产过程中往往有脱碳(即脱除气体混合物中二氧化碳)过程,使混合气体中二氧化碳经加压吸收、减压加热解吸可获得高纯度的二氧化碳气。
- 吸附膨胀法
一般以副产物二氧化碳为原料气,用吸附膨胀法从吸附相提取高纯二氧化碳,用低温泵收集产品;也可採用吸附精馏法製取,吸附精馏法採用硅胶、3A分子筛和活性炭作吸附剂,脱除部分杂质,精馏后可製取高纯二氧化碳产品。
- 炭窑法
由炭窑窑气和甲醇裂解所得气体精製而得二氧化碳。
实验室製取
- 大理石与稀盐酸反应製取
口诀
实验室制二氧碳,大理石与稀盐酸。两种苏打皆不用,速度太快控制难。
不用硫酸代盐酸,镁盐不如钙盐廉。硝酸见光易分解,验满瓶口火不燃。
反套用品
大理石或石灰石(主要成分是CaCO3)和稀盐酸。(实验室制二氧碳,大理石与稀盐酸)
反应原理
反应方程式: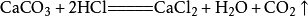 。
。
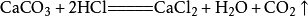
製取装置
固-液不加热型(如图)。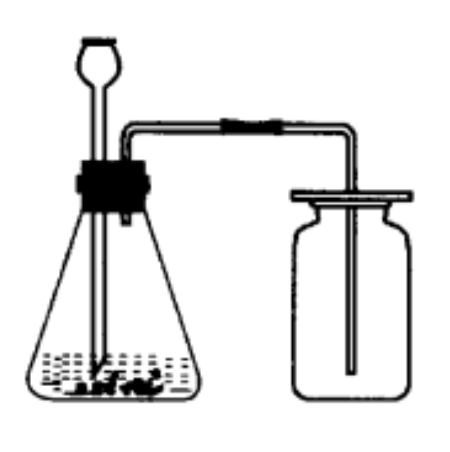 二氧化碳製取装置
二氧化碳製取装置
 二氧化碳製取装置
二氧化碳製取装置收集方法
由于二氧化碳密度比空气大,能溶于水且能与水反应,所以採用向上排空气法。
检验方法
将生成的气体通入澄清的石灰水,石灰水变浑浊,证明该气体为二氧化碳。
验满方法
用燃着的木条被在集气瓶口(不能伸入瓶内),如果火焰熄灭,证明已集满。
注意事项
①反应时可能挥发出的氯化氢(HCl)气体,可通过饱和碳酸氢钠(NaHCO3)溶液除去生成气体中的氯化氢气体。
②必要时可用装有浓硫酸的洗气瓶除去生成气体中水蒸气。
③不能用碳酸钙和浓盐酸反应,原因:浓盐酸易挥发出大量氯化氢气体,使碳酸氢钠无法完全去除,製得的二氧化碳纯度会下降。
④在实验室中是用大理石(CaCO3)和稀盐酸反应来製取二氧化碳。
⑤不能用Na2CO3(苏打)和NaHCO3代替CaCO3(小苏打)跟盐酸反应来製取二氧化碳,原因:Na2CO3和NaHCO3跟盐酸反应的速度太快,产生的二氧化碳很快逸出,不易控制,也不便于操作。(两种苏打皆不用,速度太快控制难)
⑥不能用稀硫酸代替盐酸,原因:稀硫酸跟大理石(CaCO3)反应会生成了微溶入水的硫酸钙(CaSO4)沉澱覆盖在大理石的表面上,阻碍了反应的继续进行,而使反应非常缓慢。(不用硫酸代盐酸)
⑦不能用MgCO3(镁盐)代CaCO3(钙盐),原因:虽然MgCO3跟盐酸与CaCO3跟盐酸反应相似,但由于MgCO3的来源较少,不如CaCO3廉价易得。(镁盐不如钙盐廉)
⑧不能用硝酸代替盐酸,原因:硝酸见光易分解(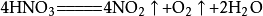 ),若用硝酸代替盐酸,则製得的CO2中就会有少量的NO2和O2。此外,硝酸的价格较盐酸贵,故通常不用硝酸代替盐酸。(硝酸见光易分解)
),若用硝酸代替盐酸,则製得的CO2中就会有少量的NO2和O2。此外,硝酸的价格较盐酸贵,故通常不用硝酸代替盐酸。(硝酸见光易分解)
⑨因为二氧化碳能灭火,故可以将燃着的火柴置于集气瓶口检验,若火焰熄灭,则证明二氧化碳已经充满了集气瓶。(鉴别火柴不能燃)
- 加热使碳酸氢钠分解製取
将碳酸氢钠充分乾燥后装入硬质玻璃管中,在管口处装填玻璃棉后封闭,用抽气泵抽真空。然后,加热使碳酸氢钠分解。最初发生的二氧化碳可放掉。分解产生的气体需导入用冰冷却的导管中,使气体中的水蒸气冷凝下来,再将气体先后导入分别装有氯化钙和五氧化二磷的U形管中使其乾燥。100℃时,碳酸氢钠的分解压为97.458kPa,120℃时为166.652kPa。
其他製法
小苏打(主要成分是碳酸氢钠)和白醋混合在一起时,发生複分解反应,放出二氧化碳气体,相应的化学反应方程式为: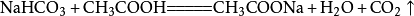 。
。
主要套用
高纯二氧化碳主要用于电子工业,医学研究及临床诊断、二氧化碳雷射器、检测仪器的校正气及配製其它特种混台气,在聚乙烯聚合反应中则用作调节剂。
固态二氧化碳广泛用于冷藏奶製品、肉类、冷冻食品和其它转运中易腐败的食品,在许多工业加工中作为冷冻剂,例如粉碎热敏材料、橡胶磨光、金属冷处理、机械零件的收缩装配、真空冷阱等。
气态二氧化碳用于碳化软饮料、水处理工艺的pH控制、化学加工、食品保存、化学和食品加工过程的惰性保护、焊接气体、植物生长刺激剂,在铸造中用于硬化模和芯子及用于气动器件,还套用于杀菌气的稀释剂(即用氧化乙烯和二氧化碳的混台气作为杀菌、杀虫剂、熏蒸剂,广泛套用于医疗器具、包装材料、衣类、毛皮、被褥等的杀菌、骨粉消毒、仓库、工厂、文物、书籍的熏蒸)。
液体二氧化碳用作致冷剂,飞机、飞弹和电子部件的低温试验,提高油井採收率,橡胶磨光以及控制化学反应,也可用作灭火剂。
超临界状态的二氧化碳可以用作溶解非极性、非离子型和低分子量化合物的溶剂,所以在均相反应中有广泛套用。
计算化学数据
疏水参数计算参考值(XlogP) | 0.9 |
氢键供体数量 | 0 |
氢键受体数量 | 2 |
可旋转化学键数量 | 0 |
互变异构体数量 | 无 |
拓扑分子极性表面积 | 34.1 |
重原子数量 | 3 |
表面电荷 | 0 |
複杂度 | 18.3 |
同位素原子数量 | 0 |
确定原子立构中心数量 | 0 |
不确定原子立构中心数量 | 0 |
确定化学键立构中心数量 | 0 |
不确定化学键立构中心数量 | 0 |
共价键单元数量 | 1 |
(表格参考资料:)
安全措施
自然环境方面
- 环境危害
天然的温室效应:大气中的二氧化碳等温室气体在强烈吸收地面长波辐射后能向地面辐射出波长更长的长波辐射,对地面起到了保温作用。
增强的温室效应:自工业革命以来,由于人类活动排放了大量的二氧化碳等温室气体,使得大气中温室气体的浓度急剧升高,结果造成温室效应日益增强。据统计,工业化以前全球年均大气二氧化碳浓度为278ppm(1ppm为百万分之一),而2012年是全球年均大气二氧化碳浓度为393.1ppm,到2014年4月,北半球大气中月均二氧化碳浓度首次超过400ppm。
全球气候变暖:大气温室效应的不断加剧导致全球气候变暖,产生一系列当今科学不可预测的全球性气候问题。国际气候变化经济学报告中显示,如果人类一直维持如今的生活方式,到2100年,全球平均气温将有50%的可能会上升4℃。如果全球气温上升4℃,地球南北极的冰川就会融化,海平面因此将上升,全世界40多个岛屿国家和界人口最集中的沿海大城市都将面临淹没的危险,全球数千万人的生活将会面临危机,甚至产生全球性的生态平衡紊乱,最终导致全球发生大规模的迁移和冲突。 全球气候变暖漫画
全球气候变暖漫画
 全球气候变暖漫画
全球气候变暖漫画- 应对措施
低碳生活:儘量减少生活作息时所耗用的能量要,从而减低二氧化碳排放量,减少对大气的污染,减缓生态恶化。
国际法律:1992年6月在巴西举行的联合国环境与发展大会上,有153个国家签署了《联合国气候变化框架公约》,此公约自1994年3月起有效,已有176个缔约方(截至2015年2月);1997年12月,由《联契约气候变化框架公约》参加国出席的会议在日本京都召开,会议制定了《京都议定书》,作为《联契约气候变化框架公约》的补充条款,此条约自2005年2月16日起有效,已有183个缔约方(截至2009年2月);2015年11月30日—12月11日,在巴黎举行的《联契约气候变化框架公约》第21次缔约方大会暨《京都议定书》第11次缔约方大会上,来自195个国家的代表一致通过了《〈联台国气候变化框架公约〉巴黎协定》(《巴黎协定》)。
人体建康方面
研究表明,空气中二氧化碳浓度低于2%时,对人没有明显的危害,超过这个浓度则可引起人体呼吸器官损坏,即一般情况下二氧化碳并不是有毒物质,但当空气中二氧化碳浓度超过一定限度时则会使肌体产生中毒现象,高浓度的二氧化碳则会让人窒息。动物实验证明:在含氧量正常(20%)的空气中,二氧化碳的浓度越高,动物的死亡率也越高。同时,纯二氧化碳引起动物死亡较低氧所致的死亡更为迅速。此外,有人认为:在低氧的情况下,8%~10%浓度的二氧化碳即可在短时间内引起人、畜死亡。
中毒原理
高浓度二氧化碳本身具有刺激和麻醉作用且能使肌体发生缺氧窒息。
中毒症状
轻度:一般出现头晕、头痛、肌肉无力、全身酸软等不适之感。
中度:头晕将有倒地之势;胸闷,鼻腔和咽喉疼痛难忍,呼吸紧促,胸部有压迫及憋气感;剧烈性头痛、耳鸣、肌肉无力、皮肤发红、血压升高,脉快而强。
重度:突然头晕无法支持而倒地,憋气、呼吸困难、心悸、神志不清、昏迷、皮肤口唇和指甲青紫、血压下降、脉弱至不能触及,瞳孔散大。对光反射消失,全身鬆软,声门扩大,相继呼吸心跳停止而至死亡,急性期过后有的可留有嗜睡及记忆力减退等症状。
急救措施
①迅速地使中毒者脱离高浓度的二氧化碳环境,到空气新鲜处,解松中毒者衣领,人工辅助呼吸以使其儘快吸入氧气,必要时用高压氧治疗,抡救人员应佩带有效的呼吸防护器。
②注射呼吸兴奋剂,有继发感染的给予抗生素;二氧化碳结合力下降应静脉滴注碳酸氢钠或乳酸钠;四肢痉摩可以服用较大剂量的镇静剂;长期高热和惊厥可用镇静药物;其它如肺水肿、脑水肿等应对症处理。
预防方法
进入含有较高浓度二氧化碳的工作区域前,检查空气中二氧化碳浓度是否超过了2%,若超过,则需要採取有效的安全措施,如:①进行通风排毒,置换工作场所空气,使空气中二氧化碳浓度不超过了2%;②佩戴送风面盔、自吸式导管防毒面具、氧气呼吸器等常用的贩毒面具。
储存注意事项
二氧化碳适宜储存于阴凉、通风的不燃气体专用库房,适合以液态或固态形式装运。储存、运输二氧化碳时需要注意以下几点:①远离火种、热源,库温不宜超过30℃;②与易(可)燃物分开存放,切忌混储;③储区应备有泄漏应急处理设备。
相关法规
在中国,二氧化碳是2007年4月12日发布、2007年11月1日实施的 《工作场所有害因素职业接触限值第1部分:化学有害因素》(GBZ 2.1-2007)中的第90种物质,在卫生要求方面,其工作场所中的时间加权平均容许浓度(permissible concentration-time weighted average,PC-TWA)为9000mg/m3、短时间接触容许浓度(Permissible concentration-Short Term Exposure Limit,PC-STEL)为18000mg/m3。此外,与二氧化碳密切相关的国家法规是规定了公共场所空气中二氧化碳浓度的测定方法的国家标準《公共场所空气中二氧化碳测定方法》(GB/T 18204.24-2000),此标準已经被2014年9月3日发布、2014年12月1日实施的《公共场所卫生检验方法 第2部分:化学污染物》(GB/T 18204.2-2014)代替。对于二氧化碳的检测,《公共场所卫生检验方法 第2部分:化学污染物》推荐採用的标準检测方式有3种检测方法,即不分光红外线气体分析法(最低检出浓度为0.01%)、气相色谱法(最低检出浓度为0.014%)、容量滴定法(最低检出浓度为0.001%)。
在美国,美国政府工业卫生学家会议(American Conference OF Governmental Industrial Hygienists,ACGIH)阈值浓度、美国职业安全与健康管理局(Occupational Safety and Health Administration,OSHA)允许浓度值和美国国家职业安全卫生研究所(National Institute for Occupational Safety and Health,NIOSH)推荐浓度值均为5000ppm(5000×10-6)。
 海之美文新闻资讯
海之美文新闻资讯