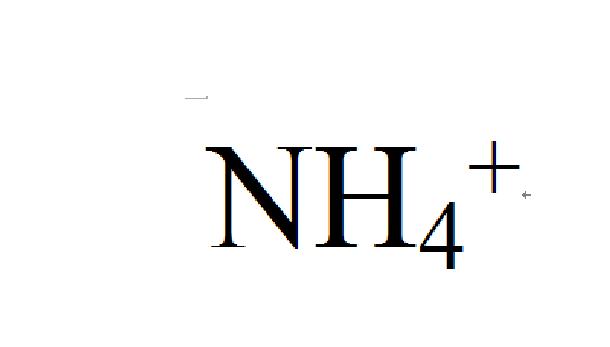
铵根
铵根是由氨分子衍生出的带正电离子。氨分子得到一个质子(氢离子)就形成铵离子。由于化学性质类似于金属离子,故命名为“铵”,属于原子团。一般被视为金属离子。
其化学式:NH4;离子化学式:NH4+。水解呈酸性,正四面体型,与甲烷互为等电子体。铵根有三个共价键和一个配位键。
基本介绍
- 中文名:铵根
- 化学式:NH4(+)
- 分子量:18
- 水溶性:铵盐均易溶于水
- 套用:铵态氮肥
简介
【拼音】 ǎn gēn
【化学式】NH4+
【离子化学式】NH4+
【立体构型】正四面体型,与甲烷互为等电子体。
【释义】是由氨分子衍生出的正价离子。氨分子得到一个质子就形成铵离子。由于化学性质类似于金属离子,故命名为“铵”,属于原子团
【相关】遇大量氢氧根(OH-)易生成氨气(NH3)和水
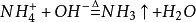
铵盐一般为易溶于水的白色晶体,可用做肥料。
【相对分子质量】18
铵根一般被视为金属离子,故命名铵。
【性质】溶于水呈弱酸性
铵盐的性质
皆为晶体,易溶于水,常伴有吸热现象。在水溶液中水解一般呈弱酸性(除某些弱酸Ka值≤氨的Kb值的铵盐,例如醋酸铵、氰化铵等)。
加热则出NH3,是铵盐的重要检验方法之一。热分解情况与对应的酸有关。一般非氧化性酸的铵盐(如NH4Cl,NH4Br,(NH4)3PO4等)热分解产物为NH3与对应酸。氧化性酸的铵盐热分解比较複杂,产物有N2或其氧化物出现,如:

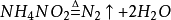
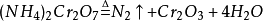
注:以上只是较为常见的方程式,具体情况可能不同。
强酸铵盐与弱酸铵盐相比,弱酸铵盐的稳定性较差,如NH4HCO3,(NH4)2CO3等在常温条件下就缓慢分解成NH3、CO2和水蒸气而损失。
鉴定方式
硷性溶液中的(奈斯勒试剂或称铵态氮试剂)是鉴定铵根离子的特效试剂。
在试液中加入少量氢氧化钾,然后煮沸,将沾有奈斯勒试剂的滤纸放在试管口检测逸出气体中是否有氨气。
如果没有干扰离子可以直接往试液中加入奈斯勒试剂检验。
奈氏试剂检验铵离子的主要反应式为:
2HgI42-+NH4++4OH-=[Hg2NH2O]I(红)+7I-+3H2O
作用后产生黄色或棕色(高浓度时)沉澱。
製备方式
①製备四碘合汞(II)酸银(I):Ag2(HgI4),在45~50℃由黄色可逆地变为红色。
2AgNO3+K2(HgI4)=Ag2(HgI4)↓+2KNO3
②製备四碘合汞(II)酸铜(I):Cu2(HgI4),在71℃由红色变为黑紫色。
2CuSO4+K2(HgI4)+SO2+2H2O=Cu2(HgI4)+K2SO4+2H2SO4
铵盐的硷解
铵盐会和强硷溶液在加热条件下反应生成NH3,离子方程如下: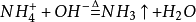
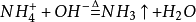
一般使用NH4Cl和NaOH(conc.代表浓):

 海之美文新闻资讯
海之美文新闻资讯