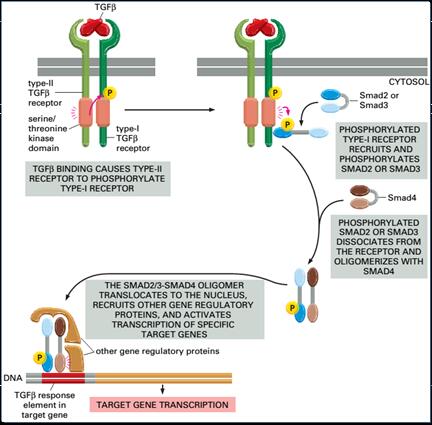
转化生长因子-β信号通路
转化生长因子-β(TGF-β)信号通路在成熟有机体和发育中的胚胎中都参与了许多细胞过程,这些过程包括细胞生长,细胞分化,细胞凋亡,细胞动态平衡等其它细胞功能。儘管TGF-β调控许多细胞过程,这些过程相对来说都比较简单。TGF-β类配体与II型受体结合,II型受体招募并磷酸化I型受体,I型受体再磷酸化受体调控的SMAD蛋白(R-SMAD),这些蛋白再与coSMAD SMAD4结合。R-SMAD/coSMAD複合体作为转录因子在细胞核内聚集,参与目标基因表达的调控。
基本介绍
- 中文名:转化生长因子-β信号通路
- 外文名:TGF-β signaling pathway
机制
与配体结合
TGF-β超家族包括:骨形成蛋白(BMP),生长分化因子(GDF),抗缪勒式管激素(AMH),激活素(Activin),Nodal及TGFβ。信号转导开始时,TGFB超家族配体与TGF-βII型受体结合。II型受体是一种丝氨酸/苏氨酸激酶受体,它催化了I型受体的磷酸化。每种配体与一种特定的II型受体相结合。在哺乳动物中,现有七种已知的I型受体和五种已知的II型受体。
有三种激活素:激活素A,激活素B,激活素AB。激活素参与胚胎髮生和骨发生。它们也调控包括垂体激素、性激素、下丘脑激素及胰岛素在内的多种激素。它们还是神经细胞存活因子。
骨形成蛋白(BMP)与2型骨形成蛋白受体(BMPR2)结合。它们参与包括骨形成、细胞分化、前后轴分化、生长及动态平衡在内的等多种细胞功能。
TGF-β超家族包括:TGFβ1, TGFβ2, TGFβ3。就像BMP一样,TGF-β参与胚胎髮生和细胞分化,但它们还参与细胞凋亡等其它功能。它们与2型TGF-β受体(TGFBR2)结合。
Nodal与IIB型激活素受体(ACVR2B)结合。之后它或者与IB型激活素受体(ACVR1B)结合形成受体複合物,或者与IC型激活素受体(ACVR1C)结合。
受体-配体结合反应在局部发生时,该类反应被归为旁分泌信号转导。
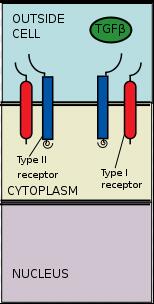 TGFβ配体与受体结合
TGFβ配体与受体结合受体招募与磷酸化
TGF-β配体与一个II型受体二聚体结合,该II型受体二聚体招募一个I型受体二聚体,并与配体形成异源四聚体複合物。这些受体是丝氨酸/苏氨酸激酶受体。它们有一个富含半胱氨酸的胞外域,一个跨膜域和一个富含丝氨酸/苏氨酸的胞内域。I型受体的GS域由一系列大约三十个丝氨酸-甘氨酸重複组成。TGF-β家族配体的结合造成受体翻转,这样它们的胞内激酶域就处于一个易于发生催化反应的方向。II型受体将I型受体的丝氨酸残基磷酸化,I型受体再激活蛋白。
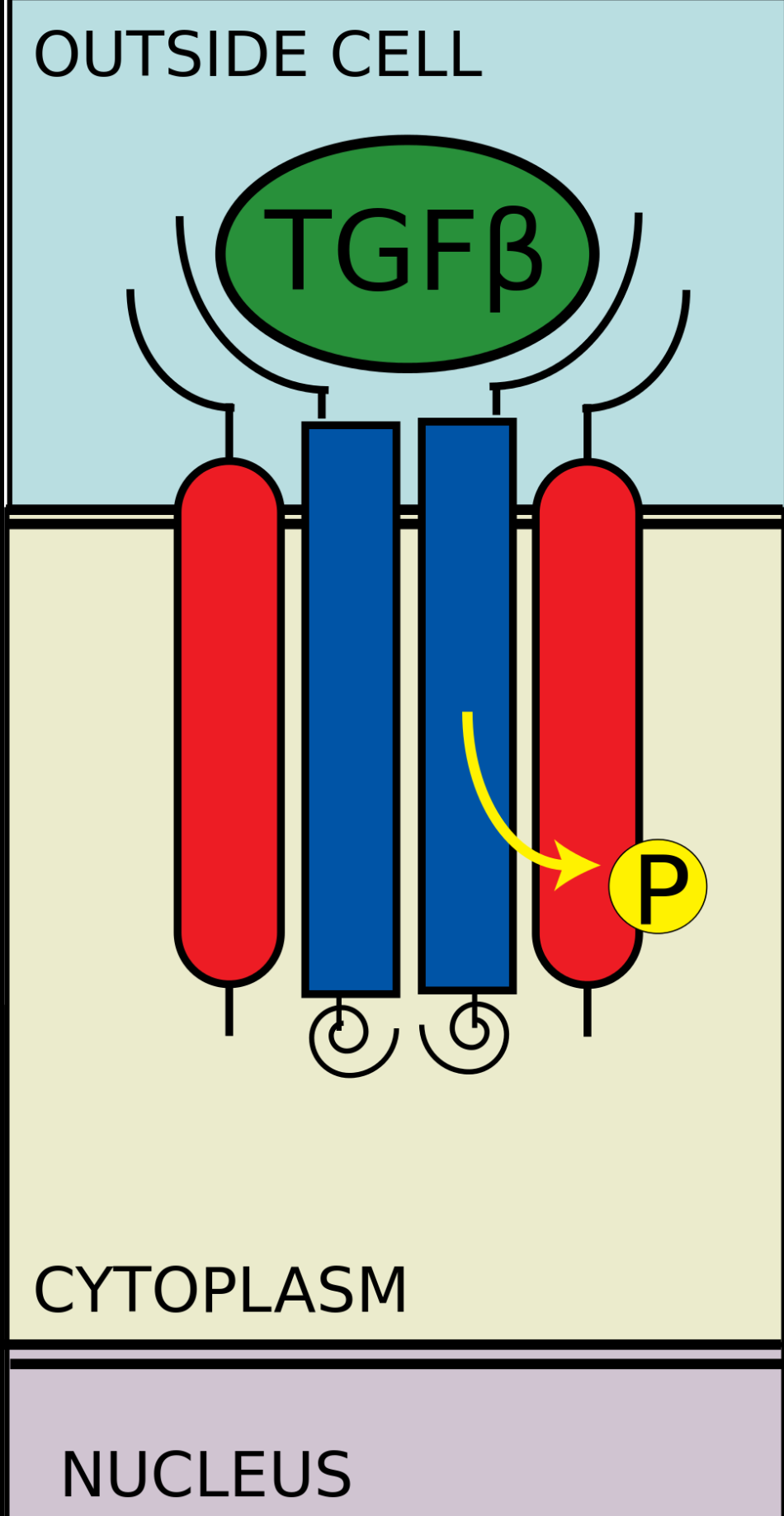 II型受体招募I型受体并将其磷酸化
II型受体招募I型受体并将其磷酸化SMAD 磷酸化
有五种受到受体调控的SMAD蛋白:SMAD1, SMAD2, SMAD3, SMAD5及SMAD9(有时也被记作SMAD8)。主要有两种胞内通路与这些R-SMAD蛋白相关。TGF-β、激活素、Nodal以及一些生长分化因子(GDF)被SMAD2及SMAD3调控,而骨形成蛋白(BMP)、抗缪勒式管激素(AMH)和个别生长分化因子(GDF)被SMAD1、SMAD5及SMAD9调控。R-SMAD蛋白与I型受体的结合由含蛋白质的FYVE锌双指结构域(zinc double finger FYVE domain)调控。SARA(The SMAD anchor for receptor activation,受体活化时SMAD的锚定点)和HGS(Hepatocyte growth factor-regulated tyrosine kinase substrate,受肝细胞生长因子调控的酪氨酸激酶的底物)是两种调控TGF-β通路的蛋白。
SARA存在于初级内体中,这些初级内体通过内吞作用摄入受体複合物,这个过程受到格线蛋白调控。SARA招募R-SMAD蛋白,SARA使R-SMAD蛋白能与I型受体的L45域结合。SARA调整R-SMAD的方向,使得其羧基端上的丝氨酸残基朝向I型受体的催化区域。I型受体将R-SMAD的丝氨酸残基磷酸化,从而导致R-SMAD中的MH2结构域发生形态改变,进而与受体複合体及SARA脱离。
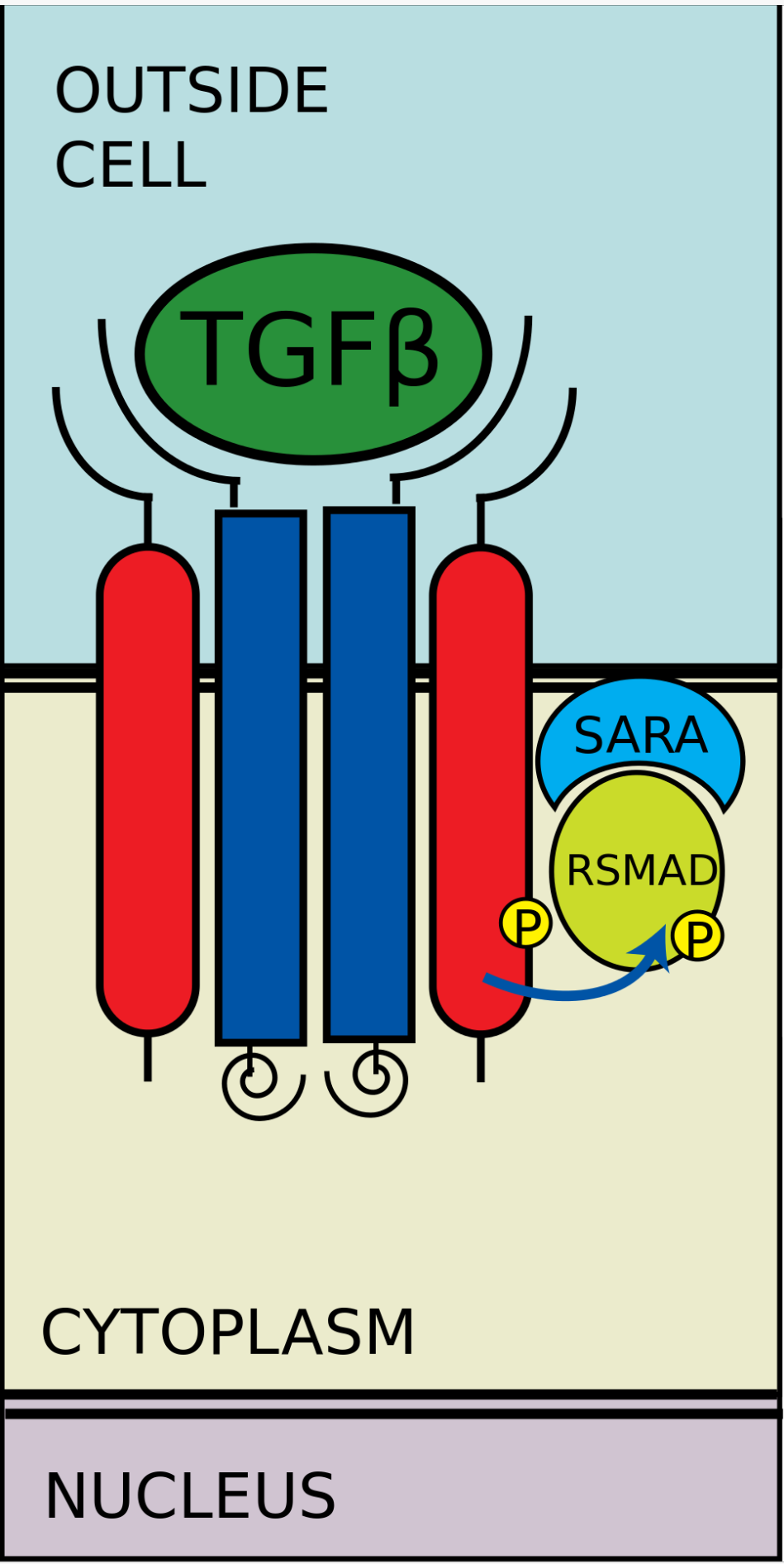 I型受体将R-SMAD磷酸化
I型受体将R-SMAD磷酸化与CoSMAD结合
磷酸化的RSMAD与coSMAD(如SMAD4)有很强的亲和力,并与coSMAD形成複合体。在这个反应中,RSMAD的磷酸基并没有作为coSMAD的停泊位点发挥作用,而是磷酸化打开了一段胺基酸,从而RSMAD和coSMAD能相互反应。
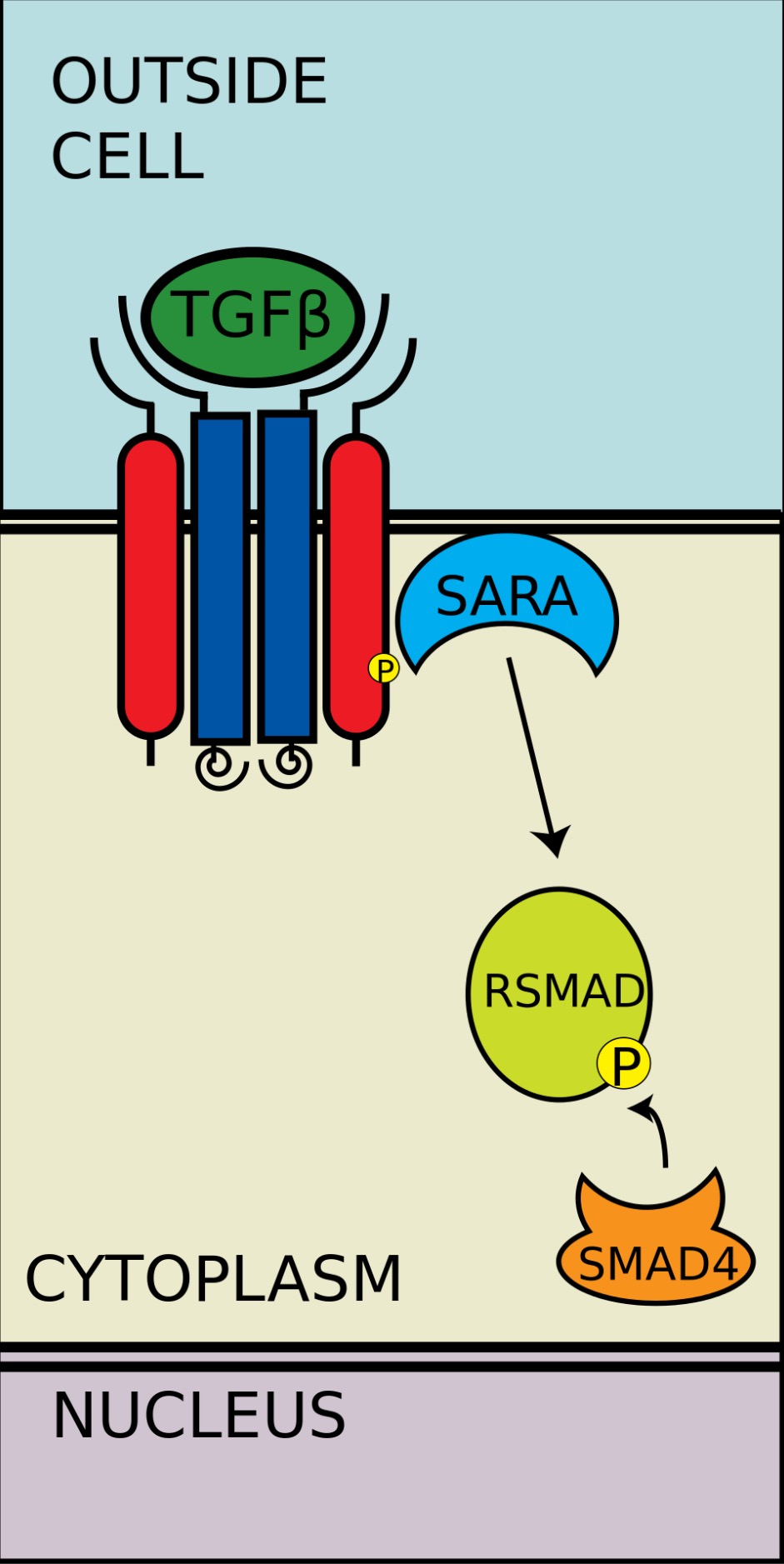 R-SMAD与coSMAD结合
R-SMAD与coSMAD结合转录
磷酸化的RSMAD/coSMAD複合物进入细胞核,与转录启动子及转录辅助因子结合,引起DNA转录。
成骨蛋白引起参与骨发生、神经形成及腹部中胚层分化的mRNA的转录。
TGF-β引起参与细胞凋亡、细胞外基质再生及免疫抑制的mRNA的转录。它也与细胞周期中的G1期阻滞有关。
激活素引起参与性腺生长、胚胎分化及胎盘形成的mRNA的转录。
Nodal引起参与左右轴分化、中胚层和内胚层形成的mRNA的转录。
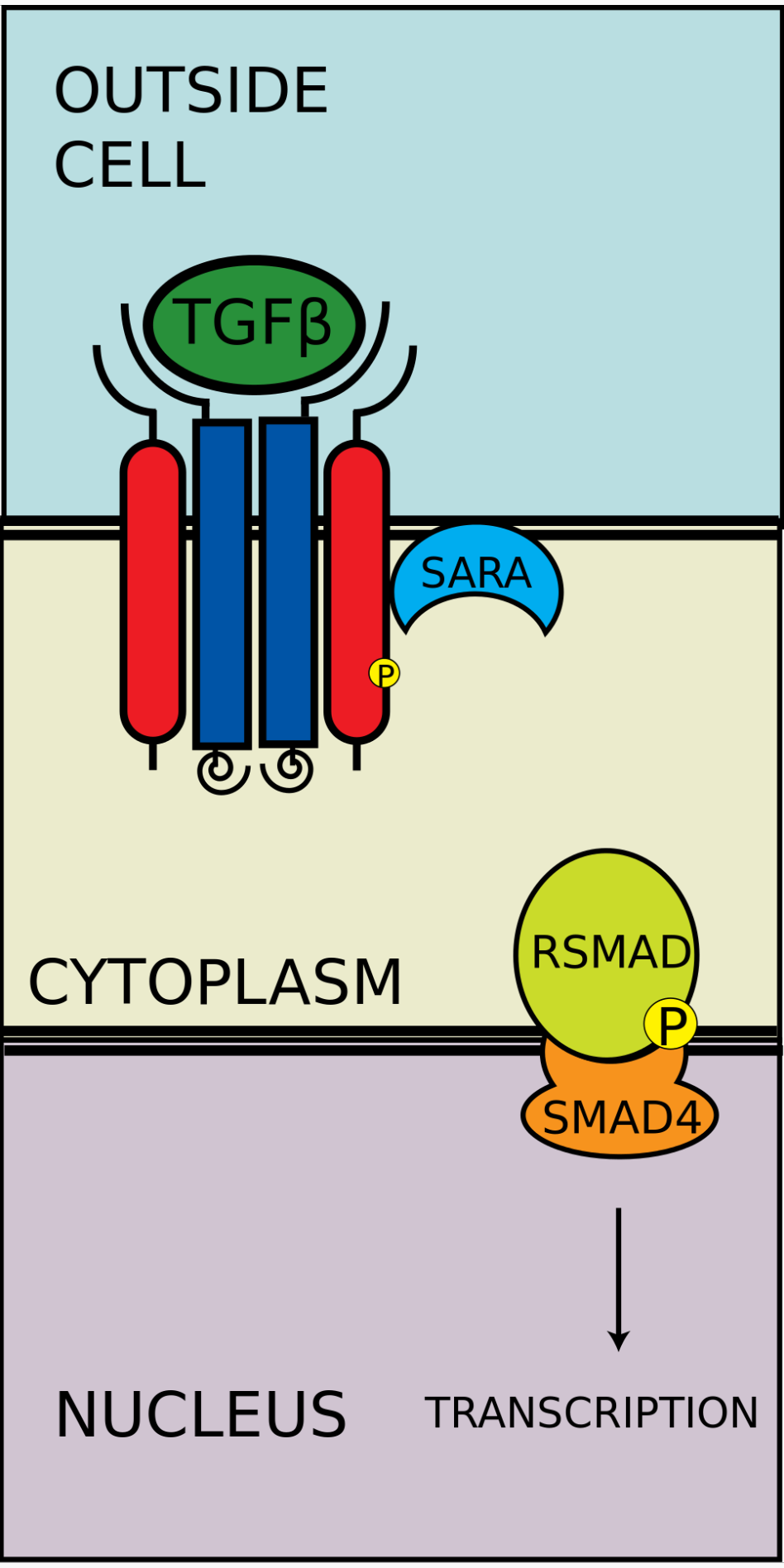 R-SMAD-coSMAD複合体进入细胞核
R-SMAD-coSMAD複合体进入细胞核通路调控
TGF-β信号通路参与许多细胞过程,因此受到频繁的调控。TGF-β信号通路有多种正反馈和负反馈调节机制,如配体和R-SMAD的激动剂,诱饵受体,R-SMAD和受体被泛素化等。
配体激动剂/拮抗剂
脊索蛋白和头蛋白都是骨形成蛋白(BMP)的拮抗剂。它们与BMP结合,阻碍其与受体的结合。有研究显示,脊索蛋白和头蛋白使中胚层形成背部组织/器官,二者都在非洲爪蟾的背唇中被发现,另外还将特定的上皮组织转化为神经组织。头蛋白在软骨形成和骨骼形成中起关键作用。
DAN家族的蛋白也与TGF-β家族成员拮抗。这些蛋白包括Cerberus,DAN以及Gremlin。这些蛋白包含可以形成二硫键的九个保守半胱氨酸。一般认为DAN与GDF5,GDF6及GDF7拮抗。
卵泡抑素与激活素结合併抑制激活素,它直接影响促卵泡激素的分泌。卵泡抑素也与前列腺癌密切相关,其基因的突变可能阻碍它对激活素的作用,而这种作用具有抗增殖的性质。
Lefty蛋白是TGF-β的一种调控因子,它参与了胚胎形成中的轴形成。它也是TGF超家族的成员。在鼠类胚胎中,这种蛋白在左侧不对称地表达,因而与左右分化相关。Lefty通过抑制R-SMAD的磷酸化产生作用,这样的过程通过一种持续性活化的TGF-βI型受体及Lefty活化的下游过程实现。
也有研究发现基于药物的拮抗剂,例如SB431542,它选择性地抑制ALK4, ALK5, and ALK7。
受体调控
转化生长因子受体3(TGFBR3)是发现的数量最多的TGF-β受体,它没有已知的信号域,但它能通过结合TGF-β并将其呈递给TGFBR2来增强TGF-β配体与TGF-βII型受体的结合。TGF-β信号通路的下游靶标之一GIPC与TGFBR3的PDZ结构域结合,抑制其蛋白酶体降解,进而增强TGF-β活性。它可能也是激活素RIL的抑制素複合受体。
BAMBI(BMP and activin membrane bound inhibitor,BMP和激活素膜结合抑制剂)与I型受体有相似的胞外域,它缺少一个丝氨酸/苏氨酸蛋白激酶胞内域,因此它是一个虚拟受体。BAMBI与I型受体结合,阻止其被激活。它是TGF-β信号通路中的负调控因子,可能在胚胎形成中抑制TGF-β表达。它的表达需要BMP信号。
FKBP12与I型受体的GS域结合,抑制II型受体将I型受体磷酸化。一般认为FKBP12及其同系物在没有配体时抑制I型受体活性,因为配体结合后它会断开与I型受体的连线。
R-SMAD调控
抑制性SMAD的功能
SMAD家族中还有两种抑制性蛋白(I-SMAD),即SMAD6和SMAD7。它们参与负反馈调节,并在TGF-β信号通路的调控中起关键作用。与其它SMAD蛋白一样,它们有一个MH1结构域和一个MH2结构域。SMAD7与其它R-SMAD蛋白竞争,与I型受体结合,并抑制其磷酸化。它们储存在细胞核中,一旦TGF-β被激活就进入细胞质并结合I型受体。SMAD6与SMAD4结合,阻碍其它R-SMAD蛋白与coSMAD蛋白结合。在TGF-β信号通路中,I-SMAD的表达水平提高,这意味着它是TGF-β信号通路的下游靶标。
R-SMAD的泛素化
E3泛素蛋白连线酶SMURF1和SMURF2调控SMAD的表达水平。与酶结合的E在酶上将泛素传递给RSMAD,导致其泛素化及蛋白酶体降解。SMURF1与SMAD1及SMAD5结合,而SMURF2 与SMAD1, SMAD2, SMAD3, SMAD6及SMAD7结合。SMURF2增强了SMAD7的抑制活动,而减少了SMAD2的转录活动。
一览表
TGF-β超家族配体 | II型受体 | I型受体 | R-SMAD | coSMAD | 配体抑制剂 |
激活素A | ACVR2A | ACVR1B(ALK4) | SMAD2,SMAD3 | SMAD4 | 卵泡抑素 |
生长分化因子1 | ACVR2A | ACVR1B(ALK4) | SMAD2,SMAD3 | SMAD4 | |
生长分化因子11 | ACVR2B | ACVR1B(ALK4),TGFβRI(ALK5) | SMAD2,SMAD3 | SMAD4 | |
骨形成蛋白 | BMPR2 | BMPR1A(ALK3),BMPR1B(ALK6) | SMAD1,SMAD5,SMAD8 | SMAD4 | 头蛋白,脊索蛋白,DAN |
Nodal | ACVR2B | ACVR1B(ALK4),ACVR1C(ALK7) | SMAD2,SMAD3 | SMAD4 | Lefty |
TGD-β | TGFβRII | TGFβRI(ALK5 | SMAD2,SMAD3 | SMAD4 | LTBP1,THBS1,核心蛋白聚糖 |
转载请注明出处海之美文 » 转化生长因子-β信号通路
 海之美文新闻资讯
海之美文新闻资讯